1 背景介绍
冠状病毒(CoV)是自然界广泛存在的一种人兽共患病病毒。最近一次是2019年由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的新型冠状病毒肺炎(COVID-19)大流行,目前仍在持续反复感染人群,威胁人类健康。COVID-19发病时引起患者发热、干咳、疲劳、腹泻、呼吸困难和咯血等症状,诱导肺等主要部位发生免疫病理改变。血管紧张素转换酶2(ACE2)是SARS-CoV-2病毒侵入人体最主要的细胞表面受体,但由于物种间的差异,SARS-CoV-2病毒无法与野生型啮齿动物的ACE2受体结合,但是通过基因编辑技术将小鼠ACE2替换为人源ACE2,就可以获得稳定表达人类ACE2受体的人源化ACE2小鼠(hACE2)。因此本研究旨在建立SARS-CoV-2滴鼻感染所致的hACE2小鼠病毒性肺炎模型,为抗体、疫苗、抗感染药物的非临床评价提供载体模型。
2 材料和方法
2.1 实验动物和病毒株
SPF级K18-hACE2雄性小鼠,共24只,6~8周龄,体质量18~26g,购自江苏集萃药康生物科技有限公司。
新型冠状病毒(SARS-CoV-2)毒株(GenBank: MT123290),从1名患者咽拭子中分离,保存于P3实验室-80℃超低温冰箱。
2.2 主要试剂和仪器
(1)主要试剂:瑞德西韦。
(2)主要仪器:电子天平,生物显微镜。
2.3 试验方法
将24只雄性hACE2小鼠按体重随机分为正常对照组、模型对照组、瑞德西韦组,每组8例动物。除正常对照组滴鼻给予生理盐水外,其他各组小鼠在乙醚轻度麻醉下,均滴鼻感染4×10
5 PFU的SARS-CoV-2 病毒。瑞德西韦组给予50 mg/kg灌胃给药,正常对照组、病毒模型对照组给予纯水灌胃给药,1次/d,连续5 d。感染后每日记录小鼠死亡情况,计算5 d死亡率。实验结束后解剖取肺组织,左肺组织置于10%中性福尔马林固定,进行常规苏木素-伊红(H-E)染色后,光镜下观察组织病理学改变情况。
3 试验结果
3.1小鼠的生存情况
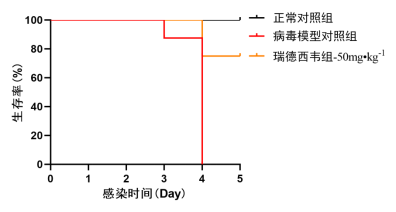
实验期间正常对照组动物无死亡发生,模型对照组体质量下降、毛发褶皱、体征虚弱和死亡。各组动物存活结果(见表1、图1)显示,攻毒第4天后,模型对照组小鼠100%死亡;攻毒第5天后,瑞德西韦组对感染SARS-CoV-2小鼠保护作用和生命延长率分别为75%和22.42%,平均生存天数为4.75d,与模型对照组相比具有显著性差异(
P<0.01)。
表1
SARS-CoV-2 病毒感染小鼠生存情况(`x±s)
|
组别 |
剂量 |
动物数/只
(始/终) |
平均存活时间/d |
死亡保护率
/% |
生命延长率
/% |
|
模型对照组 |
— |
8/0 |
3.88±0.35 |
— |
— |
|
瑞德西韦组 |
50mg·kg-1 |
8/6 |
4.75±0.46** |
75.00 |
22.42 |
注:与模型对照组比较,
**P<0.01;死亡保护率(%)=模型对照组死亡率-给药组死亡率;生命延长率(%)=(给药组平均存活时间-模型对照组平均存活时间)/模型对照组平均存活时间×100%。
图1
各组小鼠的生存曲线
3.2组织病理学改变
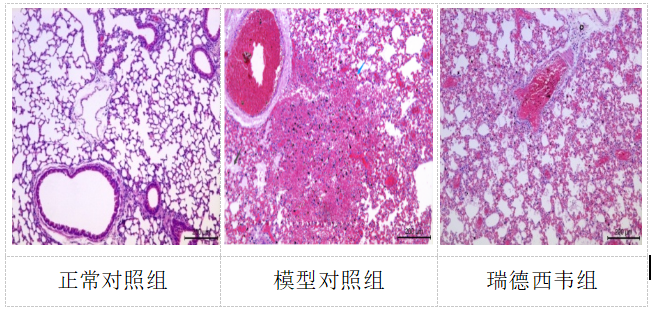
HE染色结果显示(图2),正常对照组小鼠肺内各级支气管结构正常,肺泡腔正常,间质血管未见扩张或狭窄和炎细胞浸润。模型对照组小鼠肺组织出现肺出血/淤血,间质肺炎(吞噬细胞浸润/蛋白液渗出),肺泡腔蛋白液渗出,血管/细支气管周围炎细胞浸润,支气管黏膜变性/坏死、脱落等变化,肺部病理变化指征明显。结合动物比例和病变程度,与模型对照组相比,瑞德西韦组上述病变减轻,对SARS-CoV-2感染造成的的间质性肺炎、血管/细支气管周围炎细胞浸润、肺出血/淤血等病理变化有明显的改善作用。
图2
各组小鼠肺组织病理检查结果(HE染色,×200)
4 试验结论与讨论
本研究建立的SARS-CoV-2滴鼻感染hACE2转基因小鼠模型,在感染SARS-CoV-2后,小鼠生存率明显下降,肺部间质肺炎、血管/细支气管周围炎细胞浸润等肺部病理变化指征明显,提示SARS-CoV-2感染小鼠模型造模成功。而瑞德西韦组死亡率明显下降,平均存活时间显著延长,肺组织病理改变明显,表明本研究建立的SARS-CoV-2滴鼻感染hACE2小鼠病毒性肺炎模型,能够作为筛选抗SARS-CoV-2药物的载体模型。